免除跨海求醫之苦 衛福部預告開放自體細胞治療

▲衛福部預告開放自體細胞治療,圖爲衛福部大樓。(圖/記者嚴雲岑攝)
過往希望仰賴自體細胞治療救命的患者,在國內尚未解禁的情況下,若沒有擠入人體試驗,就得跨海求援。衛生福利部今(8)日預告,開放醫療機構可經申請覈准登記後,針對符合適應症的病患施行細胞治療,最快8月底可實施。
衛福部醫事司司長石崇良表示,依現行規定,細胞治療須依醫療法規定進行人體試驗,有鑑於近年醫療技術發展迅速,且病人的確有需求之下,衛福部預告《特定醫療技術檢查檢驗醫療儀器施行或使用管理辦法修正草案》,將國外已施行、風險性較低,或已經在國內實施人體試驗累積達一定個案數,安全性可確定、成效可預期的細胞治療項目,開放民衆接受治療。
根據特管辦法規範,細胞治療是指使用人體細胞組織物,沒有結合藥物,達到人體構造或機能重建、疾病治療或預防爲目的的技術。
這次開放的細胞治療項目包含:自體周邊血幹細胞移植、自體免疫細胞治療、自體脂肪幹細胞移植、自體纖維母細胞移植、自體間質幹細胞移植以及自體軟骨細胞移植術,可運用於癌症、燒傷或困難傷口修復、腦中風以及關節炎等病人。
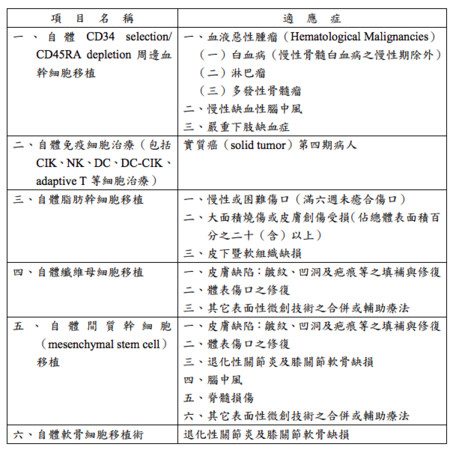
▲衛福部預告特管辦法中規劃開放的細胞治療技術項目。(圖/衛福部提供)
而特管辦法當中的細胞治療規範也排除包含輸血、使用血液製劑等常規技術,石崇良說,這些除了不屬於此次細胞治療規範項目,另外坊間有見到業者宣稱進行「細胞治療」,但根本沒有任何操作,只是把血液抽出之後再輸回,毫無治療效益的作法,排除規範是爲了避免這樣的事件發生,不使消費者受騙。
石崇良表示,要施行細胞治療的醫療機構必須擬定計劃書向中央主管機關申請覈准,並且向縣市主管機關登記,計劃必須載明施行醫師、實施項目、費用及收費方式、效果追蹤、同意書範本與不良反應救濟措施等。
涉及細胞培養或儲存者,應備有或委託符合人體細胞組織優良操作(GTP)相關規範之操作實驗室;且除病歷外,應另製作紀錄並保存10年,如接受其細胞治療之病人發生嚴重不良反應,應於7日內通報主管機關。衛福部也會要求醫院每年提結果報告,如果不良事件發生數或者嚴重度明顯異常者,將被終止施行。
衛福部強調,透過本次特管辦法大幅修正,使細胞治療技術得於有效管理下,嘉惠更多癌症病友,並免除出國求治之苦。對於預告草案有任何建議者,可於國發會公共政策網路參與平臺陳述,或與衛生福利部醫事司反應。











